产业观察:君实、信达新药相继获批上市,开辟国产单抗投资新蓝海
摘要 背景导读2018年12月17日,首个中国企业自主研发的PD-1单抗药物获批上市,填补了国产单抗的空白,受到了业内外广泛关注,此药由上海君实生物医药科技股份有限公司(以下简称:君实生物)研发生产;同月28日,信达生物制药(苏州)有限公司(以下简称:信达生物)的PD-1单抗也获批上市。国内药企自主研发的
背景导读
2018年12月17日,首个中国企业自主研发的PD-1单抗药物获批上市,填补了国产单抗的空白,受到了业内外广泛关注,此药由上海君实生物医药科技股份有限公司(以下简称:君实生物)研发生产;同月28日,信达生物制药(苏州)有限公司(以下简称:信达生物)的PD-1单抗也获批上市。国内药企自主研发的单抗药物相继获批上市,标志着中国企业在创新药领域迈进了一大步。
从近几年国内医药发展情况看,仿制药的“黄金时代”已经一去不复返,在国家经济实力增强、人们可支配收入水平提高、自主研发能力提升以及对于知识产权保护的增强,国内创新药的市场需求日益旺盛,再加上国家政策引导,越来越多的海外生物医药高端人才回流,使得本土创新药企业在新药研发上进步迅速。
何为“创新药”?创新药是指在全球范围内,从未出现过的具有自主知识产权、具有新的药理作用或治疗用途,且有临床价值的药品。它是时代发展的产物,随着医学发展、疾病克服而不断迭代。一百多年前,创新药青霉素的诞生攻克了恶性细菌感染疾病,而如今青霉素已成为人尽皆知的普通药。
创新药可分为化学药、生物药、中药三类,其中生物药疗效好、见效快,再加上政策与资本的偏好,已成为近年来发展最快的领域。生物药又细分为多个子领域:包括单抗、重组单白等,其中治疗肿瘤及自身免疫疾病为主的单抗药物,几乎占据了生物药的半壁江山,特别是用于治疗多种肿瘤的PD-1/PD-L1单抗已成为新药研发的突破点。
生物药领域的蓝海明珠——单抗PD-1/PD-L1药物
相比于化学药,生物药在治疗难治愈疾病时,具有更高的疗效,见效速度快且副作用更少,深受患者和医生喜爱。据统计,在2017年全球十大畅销药物中,有8种为生物药,销售额达678亿美元,占十种药物总销售额的83%。从全球生物药销售情况来看,2017年销售额为2402亿美元,其中单抗销售额为1038亿美元,几乎占据生物药的半壁江山,主要用于治疗肿瘤疾病和自身免疫疾病。
其中,PD-1/PD-L1单抗的免疫疗法优势得天独厚,适应症覆盖多种肿瘤疾病,市场前景广阔。其药物作用机制是通过药物刺激肿瘤患者自身的免疫系统,以产生或提高一种抗肿瘤免疫反应,从而杀死癌细胞,达到治愈肿瘤的效果。与过去传统的治疗癌症的化疗手段相比,PD-1/PD-L1这种新兴单抗药物的适应症更多,疗效更好且副作用更小。
◆全球市场:2030年PD-1/PD-L1单抗药物规模预计达到800亿美元
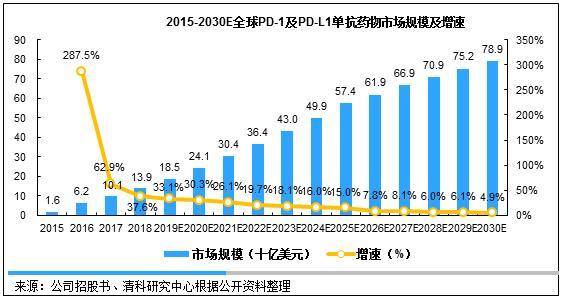
目前,全球已经获批上市的PD-1/PD-L1单抗药物共计有六种,分别是默沙东的Keytruda、BMS的Opdivo、赛诺菲的Libtayo(2018年上市)、罗氏的Tecentriq、阿斯利康的Imfinzi以及辉瑞/默克的Bavencio。除Libtayo外,其它五种药物的2017年全球销售额合计101亿美元,2015年至2017年的复合增长率达154.2%。预计未来多年,PD-1/PD-L1品种将更多样化,市场份额持续保持增长,2017年至2022年复合增长率预计达到29.3%,2022年至2030年将以10.1%的速度复合增长,预计达到800亿美元的市场规模。
图 1 2015-2030E全球PD-1/PD-L1单抗药物市场规模及增速
◆中国市场:2030年PD-1/PD-L1单抗药物规模预计达到1000亿元人民币
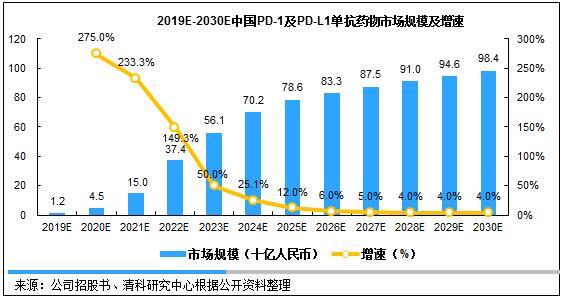
中国PD-1/PD-L1单抗药物市场仍处于发展初期,具有强劲的发展动力,未来潜力巨大。2017年中国接受PD-1/PD-L1药物治疗的可寻址患者比例约为81.5%[1]。可寻址患者为已被招募参与临床三期实验或在中国参与NDA实验的患者,以及截止至2018年6月已获批接受药物治疗的患者。中国PD-1/PD-L1的市场规模预计以534.4%的五年复合增长率增长,至2022年销售额将达374亿元人民币,并进一步增长至2030年的984亿元人民币;2022年至2030年年复合增长率将达到12.8%,中国PD-1/PD-L1单抗药物销售预计跨入千亿市场。
图 2 2019E-2030E中国PD-1/PD-L1单抗药物市场规模及增速
国产单抗百花齐放,君实、信达所研药物相继获批上市
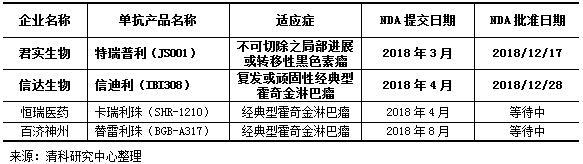
国内研发生产单抗药物的企业众多,目前在技术上处于第一梯队的有四家:君实生物、信达生物、恒瑞医药、百济神州。2018年12月17日,君实生物的PD-1单抗特瑞普利注射液(JS001)获得国家药监局的上市批准,主要用于不可切除的或转移性的黑色素瘤治疗;12月28日,信达生物的PD-1单抗信迪利注射液(IBI308)也获批上市,适应症是复发/难治性经典型霍奇金淋巴瘤;恒瑞医药和百济神州在2018年均提交了新药的上市申请,2019年有望获批,申请药物同为治疗肿瘤的PD-1单抗抑制剂,但药品适应症与君实、信达有所不同。
表 1 国产单抗药物第一梯队生产企业对比情况一览表
◆君实生物:以PD-1/PD-L1单抗为核心产品的创新驱动型生物药公司
发展历史:君实生物成立于2012年,是一家创新驱动型生物药研发公司。于2015年在新三板挂牌,2018年12月24日,君实生物作为第一家“新三板+H股”公司在香港联交所主板上市,此番上市共发行约1.59亿股,单价19.38港元,募资约30.8亿港元。
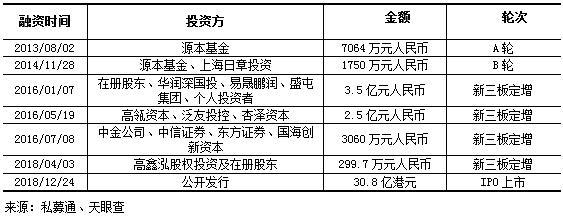
融资历程:君实生物的融资实力雄厚,从2013年8月首次获得源本基金A轮投资7064万元人民币开始,多次获得机构及个人投资者的注资。包括IPO在内,已披露融资事件达十多起,共计融资金额约40亿元人民币,参投君实的机构有源本基金、上海日章投资、高瓴资本、中金公司、中信证券等。
表 2 君实生物部分已披露融资事件列表
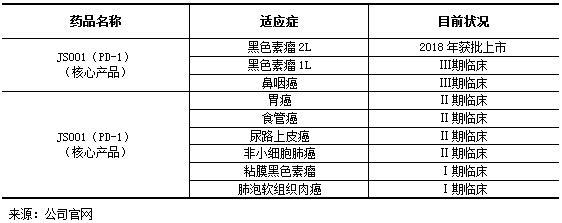
核心技术:君实生物建立的在研药品管线主要以研发肿瘤免疫疗法、自身免疫性疾病及代谢疾病类的药物为主,核心产品是PD-1/PD-L1单抗。截至2018年12月,有1种PD-1单抗药物获批上市,3个在研品种进入临床Ⅲ期,4个在研品种进入临床Ⅱ期。
表 3 君实生物部分在研药物情况一览表
◆信达生物:抗肿瘤药物为主导,拥有20种单抗候选药物
发展历史:信达生物由俞德超博士于2011年创办,致力于开发、生产和销售用于治疗肿瘤等重大疾病的单抗新药。2018年10月31日,信达生物制药在香港联交所主板挂牌上市,股票代码:01801。
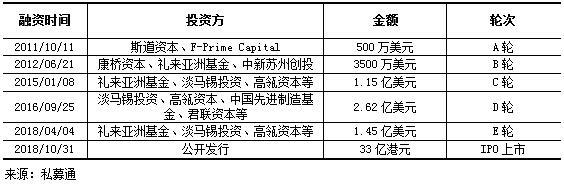
融资历程:上市前,公司已经历从A到E的五轮较大规模融资,五轮累计融资额为5.62亿美元,其中D轮融资2.62亿美元,为中国生物药行业最大的一笔私募融资,历轮融资的主要投资者包括富达、礼来亚洲基金、美国资本集团、君联资本、淡马锡、国投创新等全球多家知名创投机构。
表 4 信达已披露融资事件列表
核心技术:信达生物已建立起了一条包括20种单抗候选药物的产品链,以治疗肿瘤为主,同时覆盖眼底病、自身免疫疾病、心血管病等疾病领域,其中13个品种进入临床研究,4个品种进入临床III期研究,2个单抗产品上市申请被国家药监局受理,1个产品获批上市。
表 5 信达生物部分在研药物情况一览表

◆事件点评:君实、信达率先上市更具先发优势和价格优势,在新药研发上各有所长
君实生物与信达生物在研发生产PD-1/PD-L1单抗药物上较其他竞争企业具有先发优势。与其余本土药企相比,君实、信达在2018年12月已有新药获批上市,通常先被批准上市的药品具有更佳的业绩及更大的市场份额,这是因为医生使用该药的经验更多,也更可能开出相应处方。比竞争对手提前上市的时间越长,就越能获取先发优势,且拥有更高的定价权。
中国进口的PD-1单抗药物仅有两种,分别是默沙东的Keytruda和BMS的Opdivo。相比于这两种进口药物,君实、信达生产的PD-1单抗在治疗效果上相差无几,但国产药物在价格上更为亲民。未来,如若国产单抗药物通过谈判被纳入医保使用范围,将带来更大的收益与回报,进一步挤占进口药物的市场空间。
此外,君实、信达两家企业在新药研发上各具长处。君实生物专注于PD-1/PD-L1领域单抗药物的研发,其拥有两个单抗药物生产基地,具备完善的单抗研发平台及覆盖全产业链的生产能力,不需要外包第三方机构,能够独立进行靶点评估、研究与验证,药物发现及节选等关键环节;信达生物研发团队优势明显,具有一支国际先进水平的高端生物药开发团队,包括100多位海归专家,且信达的研发管线一直以国际化的标准建设,其药品生产线同时符合中国NMPA、美国FDA、欧盟EMA的GMP标准。2015年,信达提早布局,与美国礼来制药集团达成了两次总金额超过15亿美元的全面战略合作,未来,礼来会助力信达将获批上市的新药推向海外市场销售。
结 语
总的来说,在生物药领域,美国已经进入免疫疗法、重组多克隆抗体、双特异性抗体共存时代,处于绝对领先,而中国处于抗体药物与免疫疗法刚刚起步的阶段,但随着人民生活水平的日益提高,对克服肿瘤等难治愈疾病的需求日益急迫,整个市场环境、政策、人力、资金资本都会大力倾斜,加速国产创新药的研发速度,推动创新药蓝海市场的快速发展。未来,国内具有优质研发水平及高创新能力的创新药独角兽将会不断涌现,国产创新药势必进入百花齐放百家争鸣的时代,中国由医药大国转型成为医药强国也将指日可待。
[1] 无2018年之前的中国市场PD-1及PD-L1单抗药物的销售额数据,因此用可寻址患者数量作为统计比较。
来源:清科研究中心 李懿
更多信息请关注微信公共号清科研究(微信ID:pedata2017)



