华海转债:逐步转向创新的仿制药龙头 建议积极申购
摘要 摘要华海药业(行情600521,诊股)拟发行18.43亿元可转债,扣除费用后全部用于年产20吨培哚普利、50吨雷米普利等16个原料药项目、生物园区制药及研发中心项目以及流动资金的补充。仿制药龙头,沙坦杂质事件对业绩形成“V”形冲击。公司产品主要为涉及心血管、中枢神经、抗病毒等领域的仿制药为主,贯穿原
摘要
华海药业(600521,诊股)拟发行18.43亿元可转债,扣除费用后全部用于年产20吨培哚普利、50吨雷米普利 等16个原料药项目、生物园区制药及研发中心项目以及流动资金的补充。
仿制药龙头,沙坦杂质事件对业绩形成“V”形冲击。公司产品主要为涉及心血管、中枢神经、抗病毒等领域的仿制药为主,贯穿原料药、中间体与制剂。海外销售占比超过60%,其中三分之二以上为原料药,多个品种在美市占率较高;国内销售制剂为主,综合来看原料药与制剂各占一半。2018年公司发现缬沙坦中含有未知杂质并主动上报,导致当年美国、欧洲对公司缬沙坦产品的禁入,首次影响公司2018年利润大幅下滑,事后公司积极召回产品、与大客户进行协商处理,目前欧洲与国内的相关证书已经恢复,美国受疫情影响尚未取得、但预计也将不远,该事件进入尾声、影响总体可控,公司盈利能力也快速回升,同时积极投入研发拓展生物药、创新药等高端品种。
沙坦类药品销售有望逐步回暖,其他制剂、生物药等上市也快速推进。今年上半年公司沙坦类药品销售已经快速恢复,预计未来随着美国市场认证的恢复,该类药品的销量进一步回暖;同时在国内集采顺利,与九州通(600998,诊股)进行合作,带动国内制剂销量。除此之外,公司各个研发项目也在顺利推进,1)国内奥氮平口崩片获批上市,进一步丰富了公司的产品线;2)制剂产品盐酸哌甲酯片在美国获批,逐步迈入美国管控类产品领域;3)生物药/创新药方面,HB002.1M注射液项目、HOT-1030注射液项目、HB0017注射液项目分别核准开展3个、1个、2个新适应症临床试验。目前公司拥有66个美国ANDA批号,22个产品通过一致性评价,奠定制剂业务长期发展基础。Wind一致预期公司20年/21年净利润分别为10.42亿/14.10亿,对应PE分别为48.71X/36X。
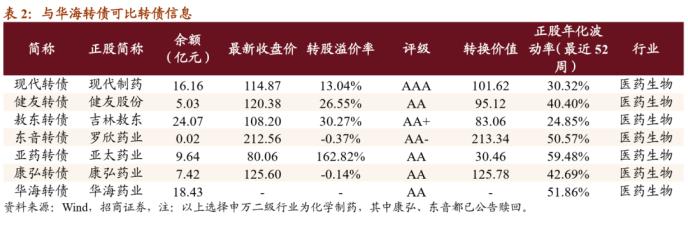
当前估值处于历史中等偏低水平,股价弹性好、机构关注度高。从估值来看,公司最新收盘价对应PE(TTM)为56.5X,估值处于历史中等偏低位置,可比公司天宇股份(300702,诊股)/仙琚制药(002332,诊股)PE(TTM)分别为24.8X/29.7X,与可比公司相比估值偏高。公司总市值508亿,股价弹性尚可,机构关注度较高。
下修严格,平价、债底保护尚可。华海转债利率为市场平均,下修条款(15/30,80%)较为严格。以对应公司发行公告日收盘价测算,转债平价为100.61元,平价保护较好;在本文假设下纯债价值为87.55元、YTM为2.41%,债底保护尚可。
综合考虑本次转债条款、正股股价与基本面,建议积极申购本期转债。本期转债评级AA、发行日平价100.61元,可比标的健友最新收盘价为120.38元、对应转股溢价率为26.55%,预计本次转债上市首日价格在120元以上;本次转债仅设置网上,假设原股东优先配售40%,则留给公众投资者的额度为11.06亿元,进一步假设网上850万户申购,则中签率在0.013%左右,建议一级市场积极申购。
风险提示:汇率波动、美国禁令解除时间推迟、集采中标不及预期
正文
1)T-1日(2020年10月30日):原股东股权登记日,配售代码“704521”,配售简称为“华海配债”,每股配售1.266元面值可转债;
2)T日(2020年11月2日):网上申购,代码为“733521”,申购简称为“华海发债”,下限为10张、1000元,上限为1万张、100万元;
3)简称为“华海转债”,债券代码为“110076”(上交所上市)。
一、可转债条款分析
公司本期可转债发行规模为18.43亿元,发行期限6年。初始转股价为34.66元,按初始转股价计算,共可转换为5316.21万股华海药业A股股票。转债全部转股对公司A股总股本的稀释率为3.65%,对流通股(非限售)的稀释率为3.65%,对流通股稀释率尚可。转股期从2021年05月06日起至可转债到期日(2026年11月1日)结束。
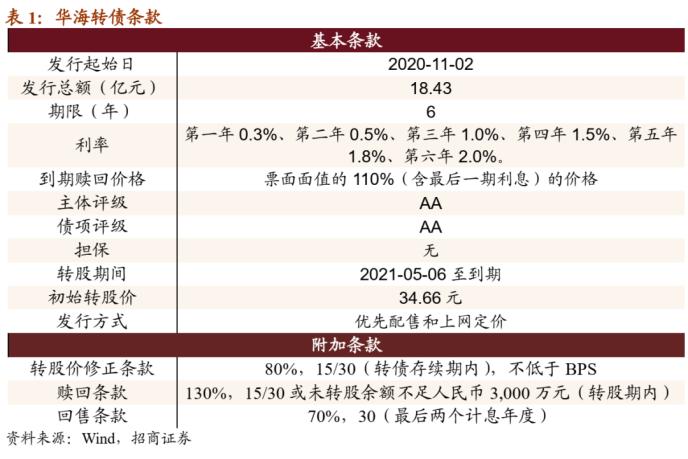
利率条款来看,可转债6年票面利率分别为0.3%、0.5%、1.0%、1.5%、1.8%、2.0%,与近期发行转债的平均票面利率水平相当;到期赎回价格为110元(含最后一期利息),也属于常规设置。
信用评级来看,上海新世纪对主体与债项分别给予AA、AA的评级。增信方面,本次可转债无担保。
就转债的附加条款来看,1)转股价修正条款(15/30,80%),较市场平均设置更为严格,且下修后有不低于每股净资产的限制;2)有条件赎回条款为(15/30,130%);3)回售条款(30,70%),赎回与回售条款为常规设置。
综合来看,公司本次发行利率处于行业平均,附加条款中下修条款严格。公司发行公告日收盘价为34.87元,对应平价为100.61元。本次发行的华海转债评级为AA、期限为6年、10月28日6年期AA评级中债企业债YTM为4.7416%、中证公司债YTM为4.7626%,综合以上本文取YTM为4.75%,测算转债纯债价值为87.55元,债底保护尚可;到期收益率为2.41%,低于同期限国债收益率。
二、正股基本面
截至三季度末,公司第一大股东陈保华持有公司25.14%的股权,为公司的控股股东兼实际控制人,陈保华先生同时担任公司的董事兼总经理。质押方面,陈保华先生质押8.16%的股权,占其持有股权比例的32.44%,质押比例尚可。
公司主要从事多剂型的仿制药、生物药、创新药及特色原料药的研发、生产和销售。制剂方面,公司形成了以心血管类、中枢神经类、抗病毒类等为主导的产品系列,主要产品有甲磺酸帕罗西汀胶囊、盐酸强力霉素缓释片、氯沙坦钾片、盐酸帕罗西汀片、盐酸多奈哌齐片、拉莫三嗪缓释片、安非他酮缓释片等。原料药方面,公司主要原料药产品包括心血管类、中枢神经类及抗病毒类等特色原料药,其中心血管类原料药主要为普利类、沙坦类药物,公司是全球主要的普利类、沙坦类原料药供应商。
公司产品同时畅销海内外,国内市场方面,截至目前公司已有21个品种过评或视同通过一致性评价。公司在2018年11月第一批“4+7”城市带量采购中中标6个产品,在2019年9月第一批联盟地区扩围的带量采购中中标7个产品,并在2019年12月份的第二批带量采购中再次中标2个产品。海外市场方面,截至2019年12月31日,公司自主拥有56个美国ANDA文号(不含FDA暂时批准),12个产品在欧盟获批上市;
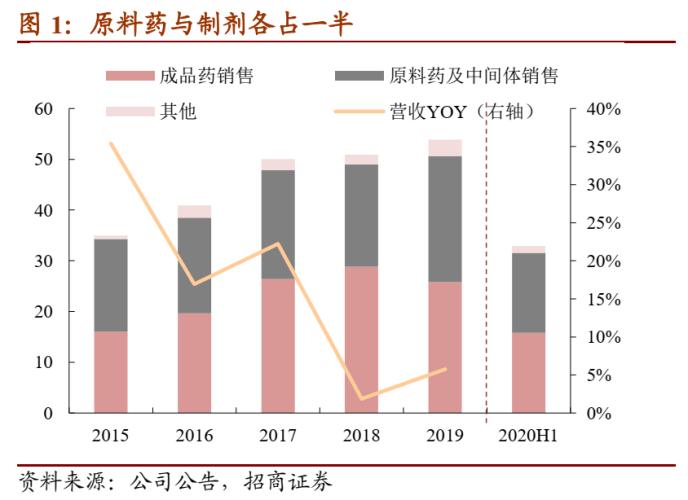
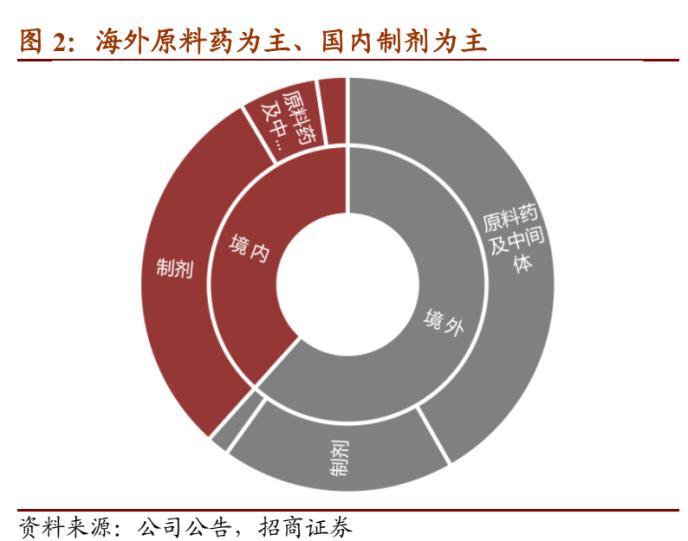
2020年上半年公司收入32.91亿元,其中原料药及中间体销售收入15.76亿元、占比47.87%,制剂销售15.88亿元、占比47.97%,两类产品各占一半。分地区来看,海外收入20.29亿元、占比61.65%,海外原料药占比超过三分之二,而国内销售以制剂为主。
缬沙坦杂质事件对公司2018年至今的经营情况造成较大影响。从公司收入来看,2018年开始公司收入增速开始大幅下滑,收入增长有所停滞。2018年6月15日,公司发现并检定其中一未知杂质为亚硝基二甲胺(NDMA),在发现该情况后公司立即主动停止了缬沙坦原料药和制剂产品的商业生产,对库存进行了单独保存,暂停所有供应,并向客户和相关监管机构进行了主动告知,随后9月28日美国FDA网站发布对公司的进口禁令警报,欧洲药监局也不再授权公司生产缬沙坦。
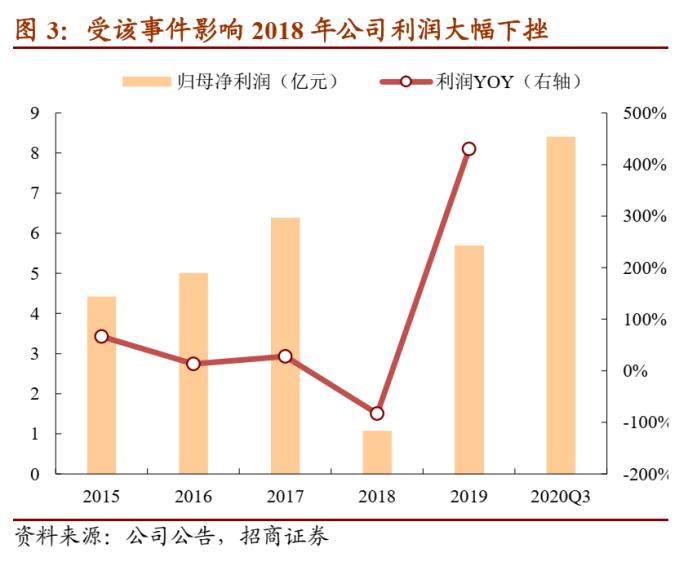
事件发生后公司积极应对处理,目前公司已取得欧洲药监局关于厄贝沙坦原料药、氯沙坦钾原料药和缬沙坦原料药CEP证书的更新证书,已取得国内缬沙坦制剂的补充申请批件并上市销售,并已向美国FDA提交整改报告、但由于疫情原因目前尚未恢复公司的原料药及制剂认证;赔偿方面,公司已与除Sandoz之外的主要缬沙坦客户就补偿事宜达成一致,Sandoz提出的未经第三方核实的赔偿总额约1.15亿美元、目前该仲裁案件实体审理尚未开始;其他消费者沟通方面,包括公司在内的超过60名多家药品生产商、批发商、零售商等均遭到诉讼,目前案件处于即决判决阶段。此外公司针对召回的缬沙坦原料药及制剂冲减了相关收入成本,针对涉及的召回费用、补偿费用等费用情况计提了预计负债,上半年已计提但尚未实际发生的预计负债余额为1.20亿元。
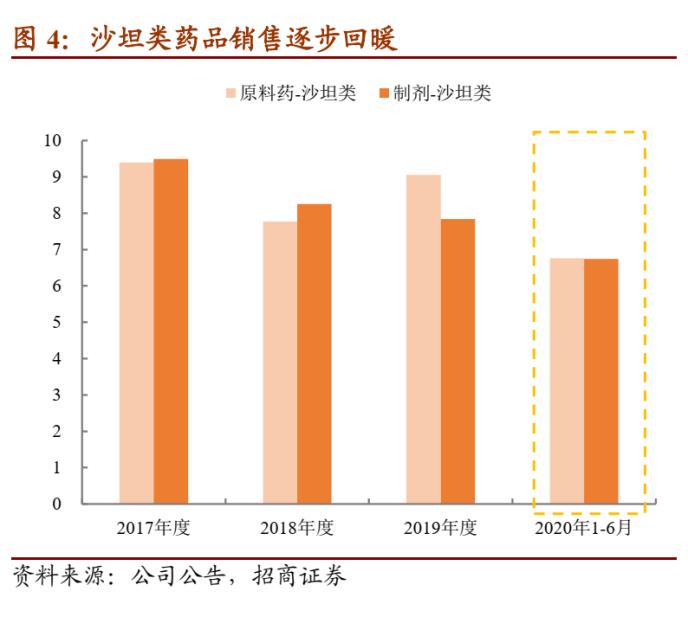
目前缬沙坦杂质事件对公司的影响已经接近尾声,相关原料药与制剂的证书逐步恢复,整体风险可控。今年上半年沙坦类药品销售已经开始回暖。
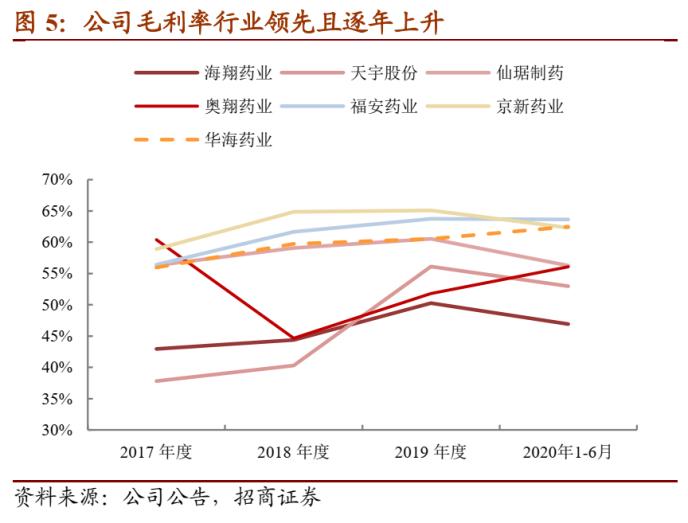
公司毛利率逐步增长且处于行业靠前。过去三年公司毛利率逐步增长,主要在于原料药销售毛利率的增长,一方面公司原料药主要出口境外,而2018年内美元汇率曾持续上升;另一方面原料药产品受江苏响水爆炸事件影响价格有所提升,导致公司原料药毛利率在2018、2019年上升。制剂产品整体毛利率较为稳定。与同业可比公司相比,由于公司同时从事原料药与制剂的生产与销售,一体化优势明显,因此毛利率处于行业靠前水平。
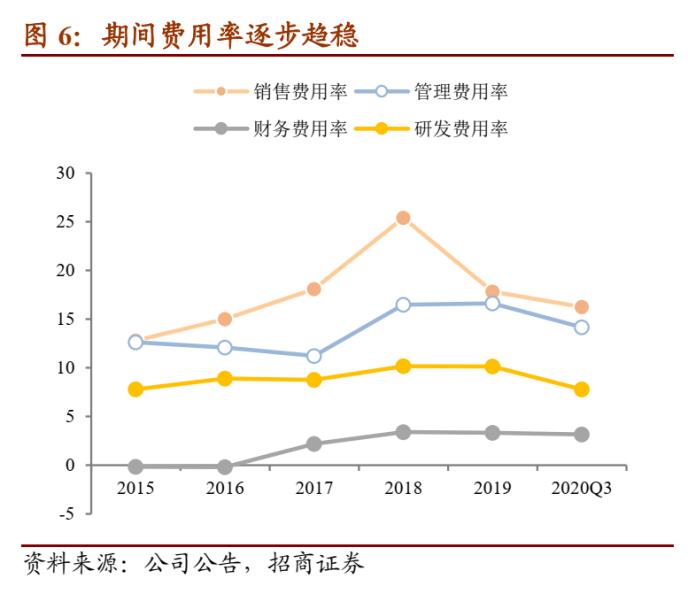
费用率逐步趋稳,研发投入不断提升。从三费来看,2018年由于缬沙坦杂质事件公司销售费用率大幅增长,之后便逐步回归、趋于稳定;管理费用率由于排污费的上升过去两年呈逐年上升的态势,财务费用率由于公司资产负债率的提升,近年也有所提升。此外公司近年研发投入明显增长,2019年公司研发费用率已经上升至10%以上。整体来看,公司近年的期间费用率逐步稳定在40%左右的水平。
公司盈利能力快速恢复并保持增长。2018年受沙坦杂质事件影响,公司期间费用率快速增长,导致公司销售净利率与ROE均大幅下降,之后公司快速反映、处理较好,2019年公司盈利能力回到2017年的水平,今年三季度公司ROE的年化水平达到18%,超过历史水平。
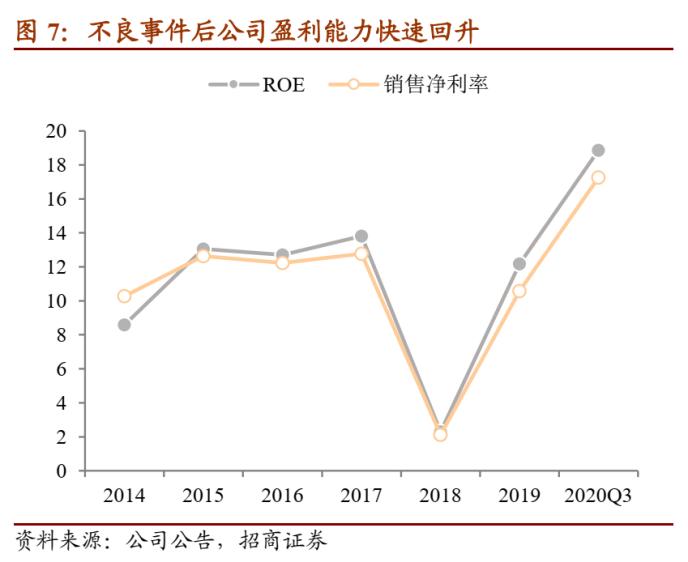
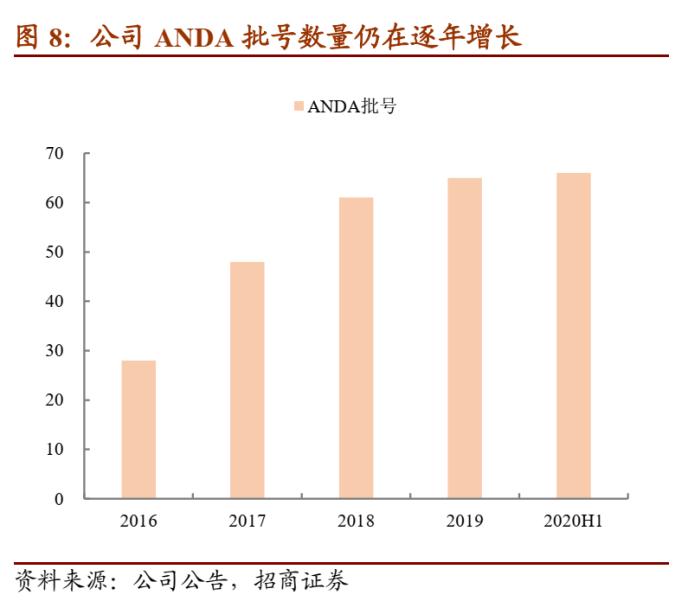
沙坦类药品销售有望逐步回暖,其他制剂、生物药等上市也快速推进。今年上半年公司沙坦类药品销售已经快速恢复,预计未来随着美国市场认证的恢复,该类药品的销量进一步回暖;同时在国内与九州通的项目合作顺利展开、带动国内制剂销量。除此之外,公司各个研发项目也在顺利推进,1)国内奥氮平口崩片获批上市,进一步丰富了公司的产品线;2)制剂产品盐酸哌甲酯片在美国获批,逐步迈入美国管控类产品领域;3)生物药/创新药方面,HB002.1M注射液项目、HOT-1030 注射液项目、HB0017注射液项目分别核准开展 3 个、1 个、2 个新适应症临床试验。目前公司拥有 66 个美国 ANDA 批号,22 个产品通过一致性评价,奠定制剂业务长期发展基础。
三、转债募投项目分析
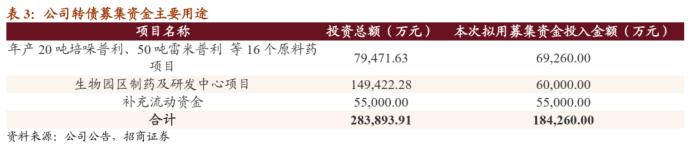
本次可转债发行规模为18.43亿元,扣除费用后全部用于年产20吨培哚普利、50吨雷米普利 等16个原料药项目、生物园区制药及研发中心项目以及流动资金的补充。
年产20吨培哚普利、50吨雷米普利等16个原料药项目。该项目建设地点位于华海建诚厂区内,由全资子公司华海建诚负责实施,产品包括20吨/年培哚普利、50吨/年雷米普利、20吨/年阿立哌唑、50吨/年喹硫平、6吨/年伏立康唑、12吨/年多奈哌齐、20吨/年拉莫三嗪、5吨/年奥氮平、30吨/年卡维地洛、3吨/年罗匹尼罗、5吨/年利培酮、12吨/年舍曲林、3吨/年酮替芬、30吨/年利伐沙班、15吨/年培南侧链、10吨/年S-苄酯等16个原料药。该项目建设期五年,年初获得项目备案与环评报告。
生物园区制药及研发中心项目。该项目建设地点位于华海生物厂区内,由全资子公司华海生物负责实施,该项目集生物药的研发、生产于一体,主要产品为单抗药物及融合蛋白药物,其适应症包括年龄相关湿性黄斑变性、强直性脊柱炎及风湿性关节炎等免疫性疾病、直肠癌及黑色素瘤等恶性肿瘤疾病。该项目围绕华海药业主营业务,系公司在医药健康领域产业升级的关键一步,公司业务由化学仿制药进一步向高端生物药拓展。该项目建设期两年,今年4月项目可行性报告已经编制完成。